
由于氟原子的独特性质(电负性强、体积小、C-F键相对惰性),分子中引入氟原子后可以很好地改变其脂溶性、结合能力和代谢稳定性,因此含氟芳香(杂)环广泛应用于医药和农药分子的设计中。目前,温和高效地选择性构建C(sp2)-F键仍然是一个重要的问题。从经济性和实用性考虑,理想构造C(sp2)-F键的方法是利用亲核氟化试剂与稳定易得的芳香(杂)环在温和条件下,无需贵金属试剂参与,反应具有很好的底物普适性。目前主要的合成方法有:SNAr氟化、Pd催化偶联氟化、酚类脱氧氟化(图1)。但是以上方法都有一些缺点,如底物普适性差、反应条件剧烈、副产物多以及需要昂贵的催化剂/试剂等。最近,美国密歇根大学的Melanie S. Sanford课题组以及陶氏化学的Douglas C. Bland等人在JACS 共同报道了酚通过芳基磺酰氟中间体脱氧氟化制备芳基氟化物的方法。
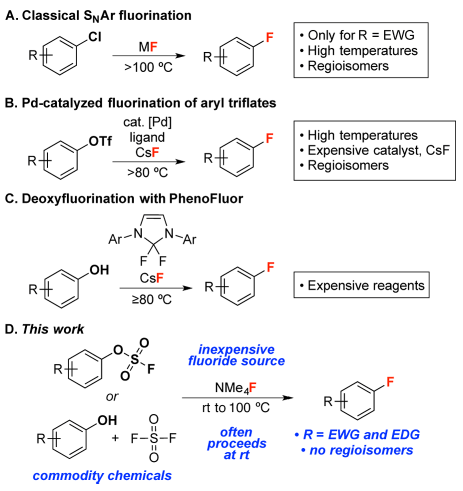
图1. 构建C(sp2)-F键的方法。图片来源:J. Am. Chem. Soc.
酚类化合物可以从生物质原料中提取,因此是一种方便易得的原料。作者设想酚可以和磺酰氟(SO2F2,一种广泛应用于农药生产中的廉价原料)反应得到芳基磺酰氟中间体(ArOFs),与NMe4F发生亲核氟化反应,从而得到目标产物(图1D)。他们首先尝试了芳基磺酰氟及其类似亲电芳基底物与NMe4F的反应速率(图2),当芳香环对位被-CN取代时,相比于其它的芳基亲电试剂,ArOFs具有更好的反应收率(entries 2−7)。当使用反应活性较差的m-Cl取代的底物时,2-Cl、2-NO2表现出较低的反应活性,而2-OFs具有67%的收率(entries 8−10)。当使用供电子取代基-Ph取代时,2-Cl、2-NO2基本未发生反应,而2-OFs在100 ℃反应条件下可以得到85%的收率。
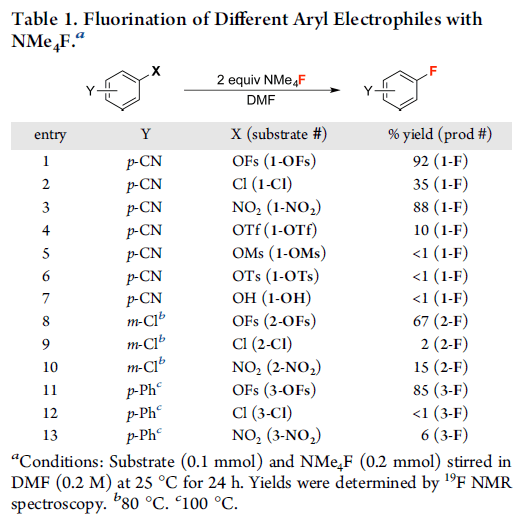
图2. 不同亲电试剂的反应速率。图片来源:J. Am. Chem. Soc.
在得到最优条件之后,作者对反应的底物普适性进行了研究(图3)。当芳环邻位或对位有吸电子基取代时,如氰基、酯基、羰基、酰胺、硝基、三氟甲基、卤素等,都可以在室温下得到理想的收率(4F-10F)。当吸电子基处于间位时,反应需要在60 ℃下进行,也可以得到产物(11F-14F),反应通过19F NMR检测,并没有其它异构体生成。该反应体系同样适用于电中性或者弱给电子取代基取代的芳基磺酰氟,比如无取代、苯基和萘基取代的底物在100℃条件下反应24 h可以得到对应的产物(15F-18F);对于弱给电子取代基取代的底物,相同条件下可以得到中等收率的产物(19F-24F)。此外,吡啶、喹啉、吲哚、咔唑、色酮等芳香杂环,在同样条件下也可以得到目标产物(25F-30F)。
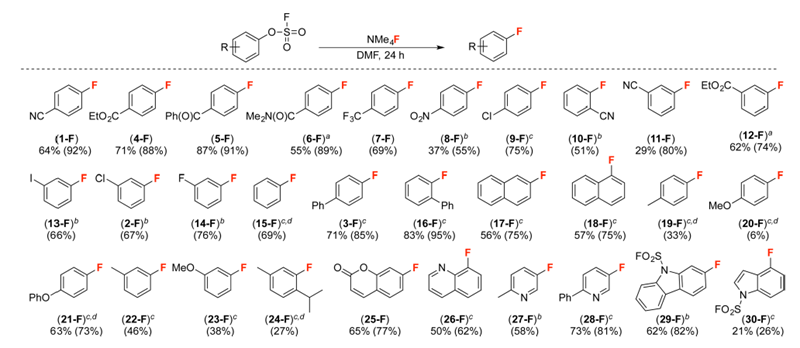
图3. ArOFs的反应普适性研究。图片来源:J. Am. Chem. Soc.
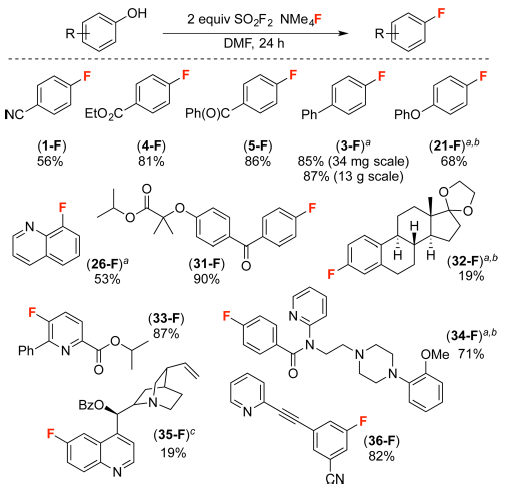
图4. 由ArOH一锅法制备ArF 图片来源:J. Am. Chem. Soc.
接下来,作者还尝试从酚作为底物出发,一锅法直接得到目标产物(图4)。可喜的是,使用3当量的NMe4F同时作为碱和氟源,ArOH和SO2F2可以一锅反应得到产物ArF。该反应对于多种酚类底物都具有很好的普适性。一锅法得到的反应收率同图3中反应分步进行的收率类似,并且由于底物稳定易得,反应投料的量由mg级别放大到13 g时,依然有良好的收率。
最后,作者对反应机理进行了研究。使用1-OFs的氟化反应为模板反应进行从头计算,得到反应过渡态势能图(图5)。1-OFs与F-反应得到五配位中间体1-A(ΔHbind= −4.1 kcal/mol for 1-OFs→1-A),该过程是热力学允许的。之后1-A转化为中间态1-TS需要13.2 kcal/mol的活化能,该过程同时包含C(sp2)−O键的断裂与C(sp2)-F键的形成。
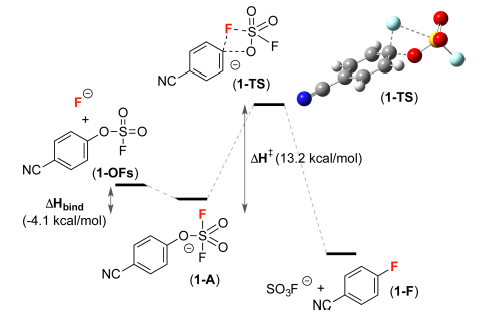
图5. 反应过渡态势能图。图片来源:J. Am. Chem. Soc.
——小结——
本文作者发展了一种由芳香(杂)环的酚为底物,一锅法条件温和的制备芳香(杂)环氟化物的方法。该亲核氟化反应对于不同的酚类底物均具有良好的普适性,且所使用的试剂廉价易得。作者利用从头计算说明反应倾向于同时进行了C(sp2)−O键断裂与C(sp2)-F键的形成的过程。此外,该方法在医药和农药分子的设计与合成中,具有潜在的应用价值。