
氟代芳香烃在医药和农药领域有着广泛的应用,如何高效合成氟代芳香烃是有机合成领域的研究热点。工业生产中在芳香烃引入氟原子的方法主要是芳香重氮盐与氟硼酸盐的Balz-Schiemann反应和卤素-氟交换反应,但是这类基于官能团转化的亲核氟化反应显然不符合原子经济性。相比之下,芳香烃的亲电氟化反应可以将Ar-H键直接转化为Ar-F键,由此成为理想的选择。早期使用的亲电氟化试剂如F2、CH3COOF、CF3OF、FClO3等虽然反应活性很高,但是本身存在有毒、易爆、不稳定等问题,且反应选择性差、副反应较多,反应条件也较为苛刻。随后人们发展了更安全、经济的N-F型亲电氟化试剂,如N-氟代吡啶盐、N-氟代苯磺酰亚胺(NFSI)和1-氟-4-甲基-1,4-二氮杂双环[2.2.2]辛烷四氟硼酸盐(Selectfluor)等。但是这类氟化试剂通常需要使用富电子或大过量的芳香化合物才能实现芳香烃的亲电氟化过程。近年来,另一类新颖的方法是通过导向基团策略设计钯催化芳香烃的C-H键活化/氧化氟化/还原消除途径将氟原子引入芳香烃中,但是使用导向基团也对反应的原子经济性和底物的适用范围造成影响。因此,寻找一种适用范围更广,特别是缺电子芳香烃C-H键氟化的新方法迫在眉睫。
德国马克斯•普朗克煤炭研究所的Tobias Ritter教授(点击查看介绍)课题组曾报道了有机金属试剂和烯胺参与的氟化反应,氟化试剂为氟转移试剂与Pd(II)络合物混合形成的Pd(IV)氟化物。最近,该课题组又成功利用这一策略实现了无导向基参与的惰性芳香烃C-H键的氟化反应,通过催化量的Pd(II)络合物与N-F型亲电氟化试剂现场生成活性更高的氟化Pd(IV)物种,并在温和的条件下与多种缺电子或富电子芳香烃发生C-H键氟化反应,生成邻位和对位取代的氟代芳香烃产物。相关成果发表在Nature 杂志上,共同第一作者为Kumiko Yamamoto博士和李家昆(Jiakun Li)博士。
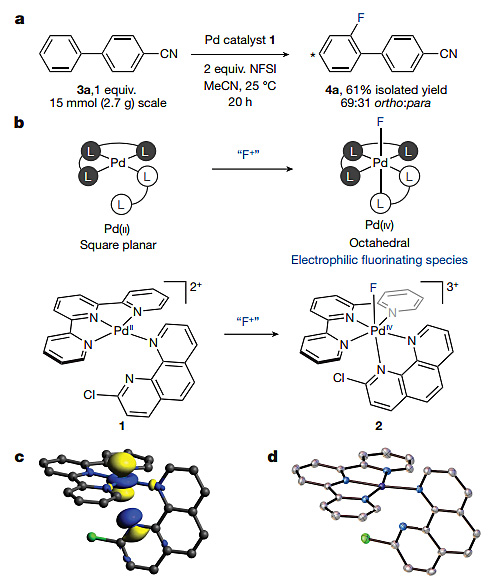
图1. Pd(II)催化剂1促进芳香烃C-H键的氟化反应。图片来源:Nature
作者设计了一种新颖的四配位结构的Pd(II)催化剂1,其中参与配位的4个氮原子中有3个来源于三联吡啶,1个来源于2-氯代-1,10-菲啰啉。他们认为1可被亲电氟化试剂氧化生成含有F-Pd(IV)键的络合物2,2基于三齿螯合与双齿螯合模式的六配位八面体结构以及高价态的金属Pd(IV)中心,能在保持一定稳定性的同时提高氟原子对芳香烃的“亲电性”。4-氰基联苯3的乙腈溶液在室温下与5 mol%的1和2当量的NFSI作用,20小时后能以61%的总分离收率及69:31的选择性得到邻位和对位氟取代的芳香烃产物4aa和4ab。
作者以5 mol%负载量的Pd(II)配合物1作为催化剂、2当量的NFSI或Selectfluor作为氟转移试剂、乙腈为溶剂,对底物的适用范围进行了考察,反应在50 ℃的条件下进行。该反应可兼容多种官能团如氰基、卤素、杂环、磺酰胺、酮、酰胺、酯、氨基甲酸酯、醚和游离的羟基。除了贫电子芳香烃如溴苯、氯苯和3,5-二(三氟甲基)联苯能较好地参与反应,一些药物分子中的芳香环也能顺利发生氟化反应,如杀虫剂腐霉利、降血糖药物那格列奈的乙酯衍生物、降血脂药物环丙贝特的丁酯衍生物和治疗低钠血症的药物托伐普坦。反应生成的邻位和对位氟代的芳香烃产物可通过高效液相色谱法分离纯化。
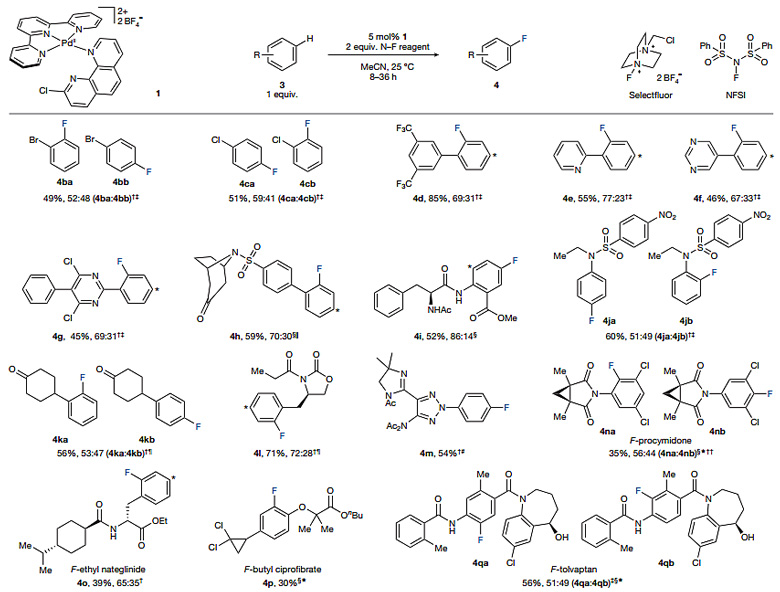
图2. 芳香烃C-H键氟化反应的底物适用性考察。图片来源:Nature
作者对该反应提出了可能的机理。首先,亲电性氟转移试剂如Selectfluor将Pd(II)催化剂1氧化,生成氟化Pd(IV)物种2,随后2与芳香烃反应生成Wheland中间体5c,消除H+得到最终产物4c,同时再生Pd(II)催化剂1。其中5c的生成途径可能有三种:(1)芳香烃底物与2发生亲电SN2取代反应;(2)经历过渡态TS的单电子转移/氟自由基迁移机理,即芳香烃的一个π电子先转移至2生成含氟的Pd(III)物种,在失去一个电子芳香烃的作用下,F-Pd(III)键断裂形成Pd(II)催化剂1和氟自由基,与此同时氟自由基与芳香烃结合生成5c;(3)经历过渡态TS的单电子转移/氟负离子迁移/单电子转移机理,即芳香烃的一个π电子先转移至2生成含氟的Pd(III)物种,在失去一个电子芳香烃的作用下,F-Pd(III)键断裂形成Pd(III)物种和F-离子,与此同时F-离子与失去一个电子的芳香烃结合,并供给Pd(III)物种一个电子,生成5c并再生Pd(II)催化剂1。DFT计算表明反应倾向于通过第三种途径发生。
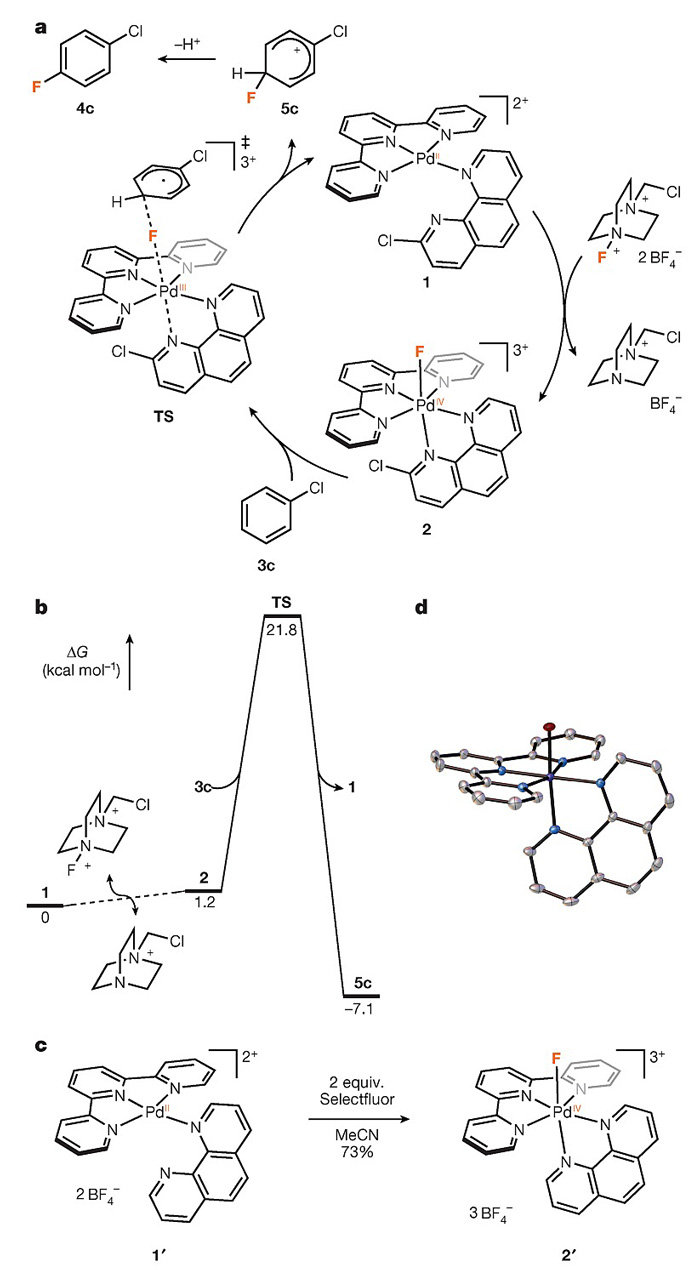
图3. 反应机理的研究。图片来源:Nature
为了进一步验证该反应中经历了F-Pd(IV)中间体,作者使用无氯原子取代的Pd(II)配合物1'与Selectfluor发生氧化反应,生成Pd(IV)氟化物2',随后化学计量的2'与芳香烃3a反应,能以63%的总分离收率和66:34的选择性得到邻位与对位氟代产物。接着,他们又分别以1和1'作为催化剂、Selectfluor为氟转移试剂对芳香烃3a的氟化进行考察,结果表明上述两个反应皆具有与化学计量实验相似的区域选择性。
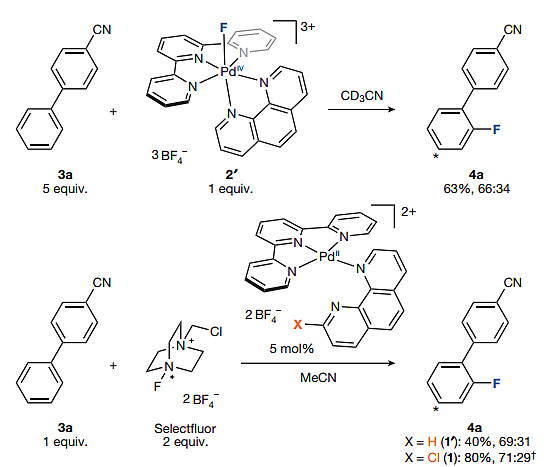
图4. 反应中F-Pd(IV)物种的验证。图片来源:Nature
Tobias Ritter教授课题组首次报道了无导向基团参与钯催化多种芳香烃的C-H键氟化反应,与以往该类反应的机理不同,反应中并不涉及C-H键活化中间体Ar-Pd(II)的生成,而是经历了氟转移试剂与Pd(II)作用生成的F-Pd(IV)中间体,该中间体可与芳香烃发生单电子转移(SET)/F-离子迁移(fluoride transfer)/单电子转移(SET)作用完成Ar-H键的氟代。该反应条件温和、操作简便,具有良好的官能团兼容性,同时适用于缺电子和富电子芳香烃底物。复杂的分子很难在不影响其他基团的情况下引入氟原子,因此目前绝大多数药物中的氟原子都是在合成路线的早期引入,由此既增加了合成成本,也限制了反应路线的选择,但Tobias Ritter教授的这一方法却能通过后期氟化(Late-stage fluorination)反应策略成功制备一系列上市药物的氟代衍生物。虽然该反应的区域选择性尚不十分理想,可同时生成邻位和对位取代的氟化产物,但不失为一种在芳香烃中简单高效引入氟原子的方法。毫无疑问,这项工作为药物化学家在含氟药物的合成、筛选和优化方面开辟了新的道路。
原文链接:https://www.nature.com/articles/nature25749